Tragbarer kapazitiver Drucksensor für die Erfassung menschlicher physiologischer Signale
Tragbarer kapazitiver Drucksensor für die Erfassung menschlicher physiologischer Signale
In den letzten Jahren haben hochempfindliche Drucksensoren mit Flexibilität, Biokompatibilität und Dehnbarkeit im Bereich tragbarer elektronischer Geräte und intelligenter Skins große Aufmerksamkeit auf sich gezogen. Es ist jedoch eine beträchtliche Herausforderung, sowohl eine hohe Empfindlichkeit als auch niedrige Kosten des Sensors zu erreichen und die beste mechanische Stabilität und eine extrem niedrige Nachweisgrenze für den Einsatz in empfindlichen physiologischen Signalüberwachungsgeräten zu erzielen. Als Reaktion auf die obigen Probleme berichtet dieser Artikel über ein einfaches Herstellungsverfahren eines hochempfindlichen und hochzuverlässigen kapazitiven Drucksensors (CPS) für die Ultra-Niederdruckmessung. TrFE) Verbund-Nanofaser-Gerüst (CNS), sandwichartig zwischen biokompatiblen Poly(3,4-ethylendioxythiophen)-Polystyrolsulfonsäure (PEDOT:PSS)/Polydimethylsiloxan (PDMS)-Elektroden Zwischen als dielektrische Schicht. Der vorbereitete Sensor hat eine hohe Empfindlichkeit von 0,51 kPa-1 und eine minimale Nachweisgrenze von 1,5 Pa. Darüber hinaus kann er auch eine lineare Erfassung in einem weiten Druckbereich (0-400 kPa) und eine hohe Zuverlässigkeit auch bei 10.000 Zyklen erreichen bei ultrahohem Druck (größer als 167 kPa). Im Vergleich zum ursprünglichen PVDF-TrFE-Nanofasergerüst kann die Empfindlichkeit des Nanofaser-basierten Sensors durch Beladen mit MXene verbessert werden, wodurch die Dielektrizitätskonstante auf 40 erhöht und der Kompressionsmodul auf 58% reduziert wird. Dieser Sensor kann den Gesundheitszustand von Patienten durch Überwachung physiologischer Signale (Pulsfrequenz, Atmung, Muskelbewegung und Augenzuckungen) bestimmen und ist ein guter Kandidat für die nächste Generation von Mensch-Maschine-Schnittstellengeräten. es kann auch eine lineare Erfassung in einem weiten Druckbereich (0-400 kPa) und eine hohe Zuverlässigkeit während 10.000 Zyklen selbst bei ultrahohem Druck (mehr als 167 kPa) erreichen. Im Vergleich zum ursprünglichen PVDF-TrFE-Nanofasergerüst kann die Empfindlichkeit des Nanofaser-basierten Sensors durch Beladen mit MXene verbessert werden, wodurch die Dielektrizitätskonstante auf 40 erhöht und der Kompressionsmodul auf 58% reduziert wird. Dieser Sensor kann den Gesundheitszustand von Patienten durch Überwachung physiologischer Signale (Pulsfrequenz, Atmung, Muskelbewegung und Augenzuckungen) bestimmen und ist ein guter Kandidat für die nächste Generation von Mensch-Maschine-Schnittstellengeräten. es kann auch eine lineare Erfassung in einem weiten Druckbereich (0-400 kPa) und eine hohe Zuverlässigkeit während 10.000 Zyklen selbst bei ultrahohem Druck (mehr als 167 kPa) erreichen. Im Vergleich zum ursprünglichen PVDF-TrFE-Nanofasergerüst kann die Empfindlichkeit des Nanofaser-basierten Sensors durch Beladen mit MXene verbessert werden, wodurch die Dielektrizitätskonstante auf 40 erhöht und der Kompressionsmodul auf 58% reduziert wird. Dieser Sensor kann den Gesundheitszustand von Patienten durch Überwachung physiologischer Signale (Pulsfrequenz, Atmung, Muskelbewegung und Augenzuckungen) bestimmen und ist ein guter Kandidat für die nächste Generation von Mensch-Maschine-Schnittstellengeräten. Im Vergleich zum ursprünglichen PVDF-TrFE-Nanofasergerüst kann die Empfindlichkeit des Nanofaser-basierten Sensors durch Beladen mit MXene verbessert werden, wodurch die Dielektrizitätskonstante auf 40 erhöht und der Kompressionsmodul auf 58% reduziert wird. Dieser Sensor kann den Gesundheitszustand von Patienten durch Überwachung physiologischer Signale (Pulsfrequenz, Atmung, Muskelbewegung und Augenzuckungen) bestimmen und ist ein guter Kandidat für die nächste Generation von Mensch-Maschine-Schnittstellengeräten. Im Vergleich zum ursprünglichen PVDF-TrFE-Nanofasergerüst kann die Empfindlichkeit des Nanofaser-basierten Sensors durch Beladen mit MXene verbessert werden, wodurch die Dielektrizitätskonstante auf 40 erhöht und der Kompressionsmodul auf 58% reduziert wird. Dieser Sensor kann den Gesundheitszustand von Patienten durch Überwachung physiologischer Signale (Pulsfrequenz, Atmung, Muskelbewegung und Augenzuckungen) bestimmen und ist ein guter Kandidat für die nächste Generation von Mensch-Maschine-Schnittstellengeräten.
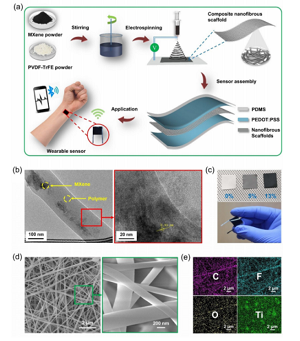
Abbildung 1. Vorbereitungsprozess und Struktur des ZNS-basierten Drucksensors. (A) Zeigen Sie das schematische Diagramm des Vorbereitungsprozesses des ZNS-basierten Drucksensors. (B) TEM-Bild von CNS, das einschichtige und mehrschichtige MXene-Nanoflake zeigt. Der Einschub ist ein hochauflösendes TEM, das den Zwischenschichtabstand von 0,93 nm entsprechend der MXene (002)-Ebene zeigt. (C) Das Foto zeigt das ZNS verschiedener MXene-Konzentrationen und den hergestellten Sensor. (D) FESEM-Bild des ZNS. Der Einschub zeigt die Morphologie bei höherer Vergrößerung. (E) Das EDS-Diagramm der zusammengesetzten Nanofasern zeigt die Elemente C, F, O und Ti.
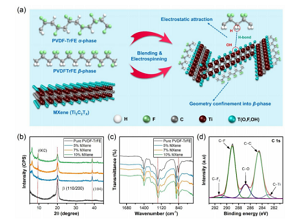
Abbildung 2. Schematische und Oberflächenmerkmale des ZNS. (A) Ein schematisches Diagramm, das die Synergie zeigt, die nach der Einführung von MXene in die Polymermatrix erhalten wurde. (B,c) XRD- und FTIR-Analyse des ZNS bei verschiedenen MXen-Konzentrationen. (D) XPS-Spektrum der C 1s-Region des ZNS mit 5 Gew.-% MXen-Konzentration.
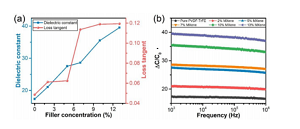
Abbildung 3. Elektrische Eigenschaften verschiedener Proben (a) Die Dielektrizitätskonstante und Verlusttangente von CNS relativ zum MXene-Gehalt (in Gew.-%). (B) Frequenzabhängigkeit der Dielektrizitätskonstante.
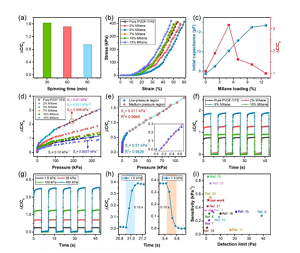
Abbildung 4. Elektromechanische Eigenschaften von ZNS-basierten Drucksensoren. (A) Leistungsvergleich von ZNS-basierten Sensoren basierend auf unterschiedlichen Elektrospinnzeiten. (B) Die Druckspannungs-Dehnungs-Leistung des Sensors unter einer stabilen Last mit einem Kompressionsabstand von bis zu 0,4 mm. (C) Die Anfangskapazität (C0) und die relative Änderung (ΔC/C0) des CNS-basierten Sensors hängen vom MXene-Gehalt (in Gew.-%) ab. (D) Die relative Kapazitätsänderung (ΔC/C0) von CNS-basierten Sensoren, die dielektrische Schichten mit unterschiedlichen MXen-Konzentrationen (in Gew.-%) enthalten, unter einem konstanten Kompressionsabstand von 0,4 mm. (E) Ein beschreibender Graph von ΔC/C0, der die Druckempfindlichkeit veranschaulicht, die erhalten wird, wenn die MXene-Beladung 5 Gew.-% beträgt. Die Abbildung zeigt die Empfindlichkeit des Sensors im Niederdruckbereich. (F) Für unterschiedliche MXene-Konzentrationen, die zyklische Kapazitätsantwort (Beladen/Entladen) von CNS-basierten Sensoren bei einem konstanten Kompressionsabstand von 0,3 mm, und (g) Bei unterschiedlichen Belastungs-/Entladedruckwerten beträgt die MXene-Konzentration 5 Gew.-% der zyklischen Kapazitätsantwort des CNS -basierter Sensor. (H) Reaktions- und Relaxationszeit in einem Lade-/Entladezyklus mit einem Druck von 1,5 kPa. (I) Im Vergleich zum vorherigen Bericht wurde die Leistung des Sensors in Bezug auf die Empfindlichkeit bei niedrigen Nachweisgrenzen im Niederdruckbereich angegeben.
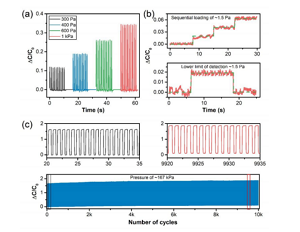
Abbildung 5. (a) Die relative Änderung der Kapazitätsantwort unter Niederspannungs-Lade- und Entladezyklen. (B) Veranschaulichen Sie die untere Nachweisgrenze (LOD) durch sequentielles Laden und Entladen von ungefähr 38 mg Langkornreis. (C) Zyklischer Stabilitätstest des CNS-basierten Drucksensors nach 10.000 Lade- und Entladezyklen unter hohem Druck von etwa 167 kPa (mehr als 40% Kompression). Der Einschub zeigt den ausgewählten Zyklus zu Beginn und am Ende des Stabilitätstests.
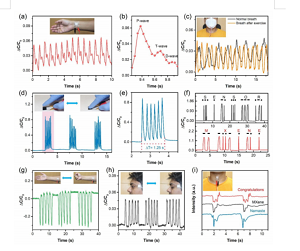
Abbildung 6. Die Anwendung von ZNS-basierten Sensoren bei der kontinuierlichen und Echtzeitüberwachung menschlicher physiologischer Signale. (A) Echtzeit-Überwachung der arteriellen Pulswelle. Abbildung: Foto des Sensors, der an der Hautstelle des Handgelenks angebracht ist. (B) Eine vergrößerte Ansicht einer einzelnen Pulswellenform, einschließlich detaillierter Informationen über ihre charakteristischen Spitzen. (C) Überwachen Sie die Atmung vor und nach dem Training. Abbildung: Foto eines an einer Maske befestigten Sensors zur Überwachung der Atemfrequenz. (D) Das Diagramm zeigt, dass der Sensor das Tippen mit dem Finger bei einer statischen Tremorfrequenz von 4,8 Hz simuliert, um die primäre Parkinson-Krankheit zu erkennen. Abbildung: Ein Foto, das einen Finger imitiert, der mit konstanter Frequenz auf die Oberfläche des Sensors tippt. (E) Ein vergrößertes Bild, das Perkussion bei einer bestimmten Tremorfrequenz von 4,8 Hz simuliert. (F) Kurzes Drücken und langes Drücken auf den Sensor kann ein internationales Morse-Code-Signal erzeugen. (G) Überwachen Sie die Muskelkontraktion und -expansion, indem Sie die Faust reversibel öffnen und schließen. Abbildung: Foto des Sensors an den Bauchmuskeln des Handgelenks. (H) Überwachen Sie das Signal, das durch die Vibration der Augenmuskeln während des Augenzuckens erzeugt wird. Abbildung: Ein Foto des an der Augenhaut angebrachten Sensors. (I) Die Fähigkeit des Sensors, verschiedene Geräusche mit sich wiederholenden und unterschiedlichen Wellenformen zu erkennen. Abbildung: Foto des Sensors an der Epidermis des Rachens. (H) Überwachen Sie das Signal, das durch die Vibration der Augenmuskeln während des Augenzuckens erzeugt wird. Abbildung: Ein Foto des an der Augenhaut angebrachten Sensors. (I) Die Fähigkeit des Sensors, verschiedene Geräusche mit sich wiederholenden und unterschiedlichen Wellenformen zu erkennen. Abbildung: Foto des Sensors an der Epidermis des Rachens. (H) Überwachen Sie das Signal, das durch die Vibration der Augenmuskeln während des Augenzuckens erzeugt wird. Abbildung: Ein Foto des an der Augenhaut angebrachten Sensors. (I) Die Fähigkeit des Sensors, verschiedene Geräusche mit sich wiederholenden und unterschiedlichen Wellenformen zu erkennen. Abbildung: Foto des Sensors an der Epidermis des Rachens.




